Regulering av transkripsjon av laktose-genene i E. coli
© Anders Skovly 2024
Ikke alle proteiner trengs hele tiden, og ikke alle proteiner trengs i like stor mengde. Ulike geners transkripsjonsrate (antall RNA produsert per minutt) kan derfor kontrolleres via diverse mekanismer. Denne artikkelen handler om hvordan transkripsjon av E. coli's laktose-gener kontrolleres via opptak av glukose og laktose.
Promoter-elementer
For å beskrive begynnelsen av transkripsjon i mer detalj vil transkripsjon fra E. coli's laktose-promoter (lac-promoter) brukes som eksempel. Lac-promoteren brukes til å transkriptere E. coli's tre laktose-gener: lacZ, lacY, og lacA. Disse genene er posisjonert på rekke i DNA, med lac-promoter på den ene siden av rekken. De tre genene transkripteres derfor sammen som en enkelt lang RNA.
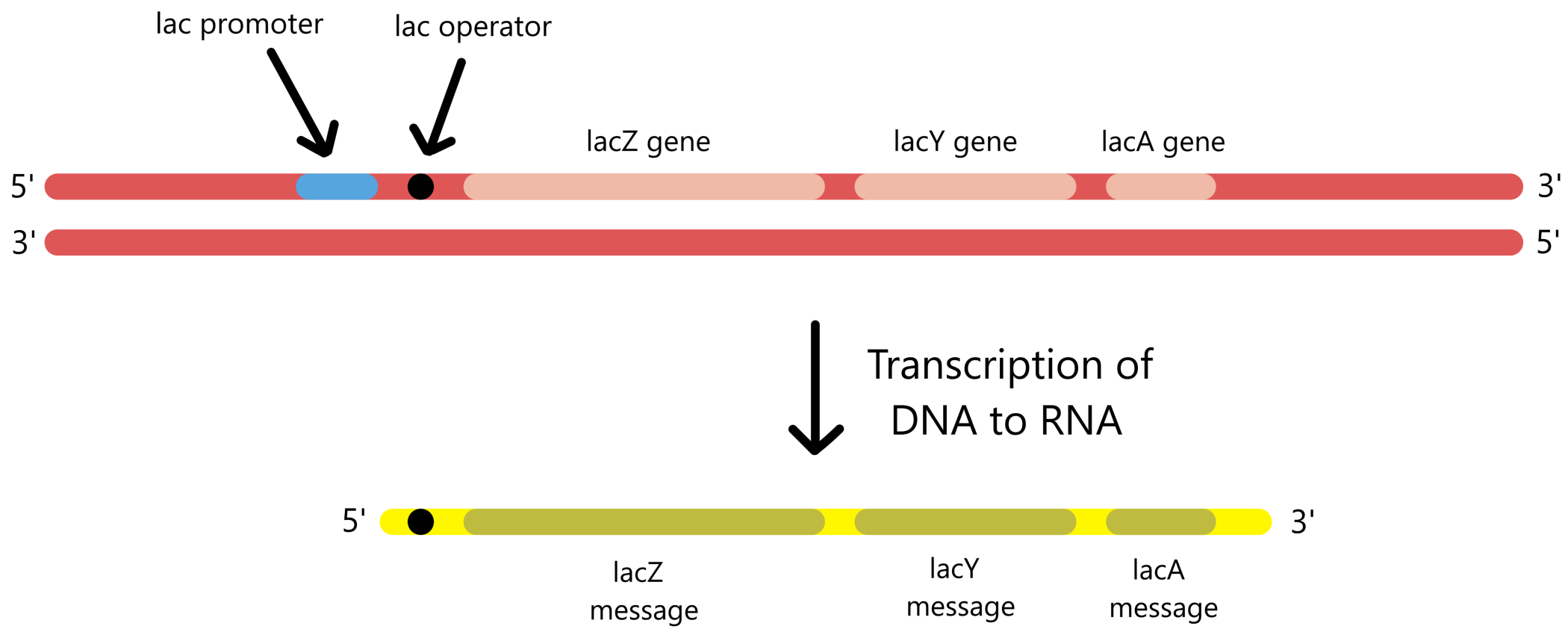
En promoter består av sekvenser kalt promoter-elementer. I lac-promoteren finnes to promoter-elementer kalt −10-sekvensen og −35-sekvensen. For at RNApol skal kunne binde til promoteren må RNApol først binde til en sigmafaktor kalt sigma70. Sigma70 kan så binde til −10/35-sekvensene, og RNApol kan begynne å transkribere.
Lac-promoteren har også et tredje promoter-element kalt CRP-sekvensen. (CRP-sekvensen er ikke det vanlige navnet på denne sekvensen, på engelsk kalles den CRP recognition sequence eller CRP binding site). Hvis proteinet CRP binder til CRP-sekvensen så vil transkripsjonsraten øke. Det er usikkert nøyaktig hvordan CRP gjør dette. Det som er sikkert er at CRP kommer i kontakt med RNApol, og det er mulig denne kontakten hjelper RNApol-sigma med å binde til −10/35-sekvensene. Alternativt er det mulig at kontakten hjelper RNApol med å åpne transkripsjonsboblen eller med å begynne å bevege seg langs DNA.
Nedenfor vises en DNA-sekvens på 105 baser som inneholder de tre nevnte promoter-elementene som utgjør lac-promoteren. Sekvensen inneholder også de første 26 basene som transkripteres fra lac-promoteren. Blant disse 26 basene finnes en fjerde sekvens kalt lac-operatoren som beskrives i neste seksjon. Sekvensen som vises er fra lac-genenes non-templat-DNA.
(Når sigma70 og CRP binder til promoter-elementene, så binder de ikke bare til non-templat-DNA, de binder til dobbelheliks-DNA som inkluderer både templat- og non-templat-DNA. Derfor, selv om promoter-elementene kun vises på non-templat-DNA i figurene, så inkluderer promoter-elementene egentlig også de komplementære sekvensene på templat-DNA.)
Under sekvensen går det en tallinje fra −79 til 26. Det finnes ikke noen null i denne linjen. Det er vanlig å gi transkripterte baser positive numre, med første transkripterte base som nummer 1. Baser som ikke transkripteres gis negative numre, med basen foran første transkripterte base som nummer −1. Sekvensen har 5'-ende ved base nummer −79 og 3'-ende ved base nummer 26.
CRP-sekvensen −35-sekvensen -10-sekvensen lac-operatoren
5'-ACGCAATTAATGTGAGTTAGCTCACTCATTAGGCACCCCAGGCTTTACACTTTATGCTTCCGGCTCGTATGTTGTGTGGAATTGTGAGCGGATAACAATTTCACA-3'
.........|.........|.........|.........|.........|.........|.........|.........|.........|.........|.....
-70 -60 -50 -40 -30 -20 -10 1 11 21
Kontroll på transkripsjon av lac-genene
Kun to av laktose-genene, lacY og lacZ, vil være i fokus i denne artikkelen. lacY oversettes til proteiner kalt laktose permeaser, som flytter laktose fra E. colis vekstmiljø gjennom cellemembranen og inn i cellen. lacZ oversettes til proteiner kalt β-galaktosidaser, som kan restrukturere laktose til allolaktose, samt bryte ned laktose eller allolaktose til glukose og galaktose. (Galaktose kan deretter restruktureres til glukose via fire andre enzymer.) Se DNA-sekvensen som transkripteres fra lac-promoteren.
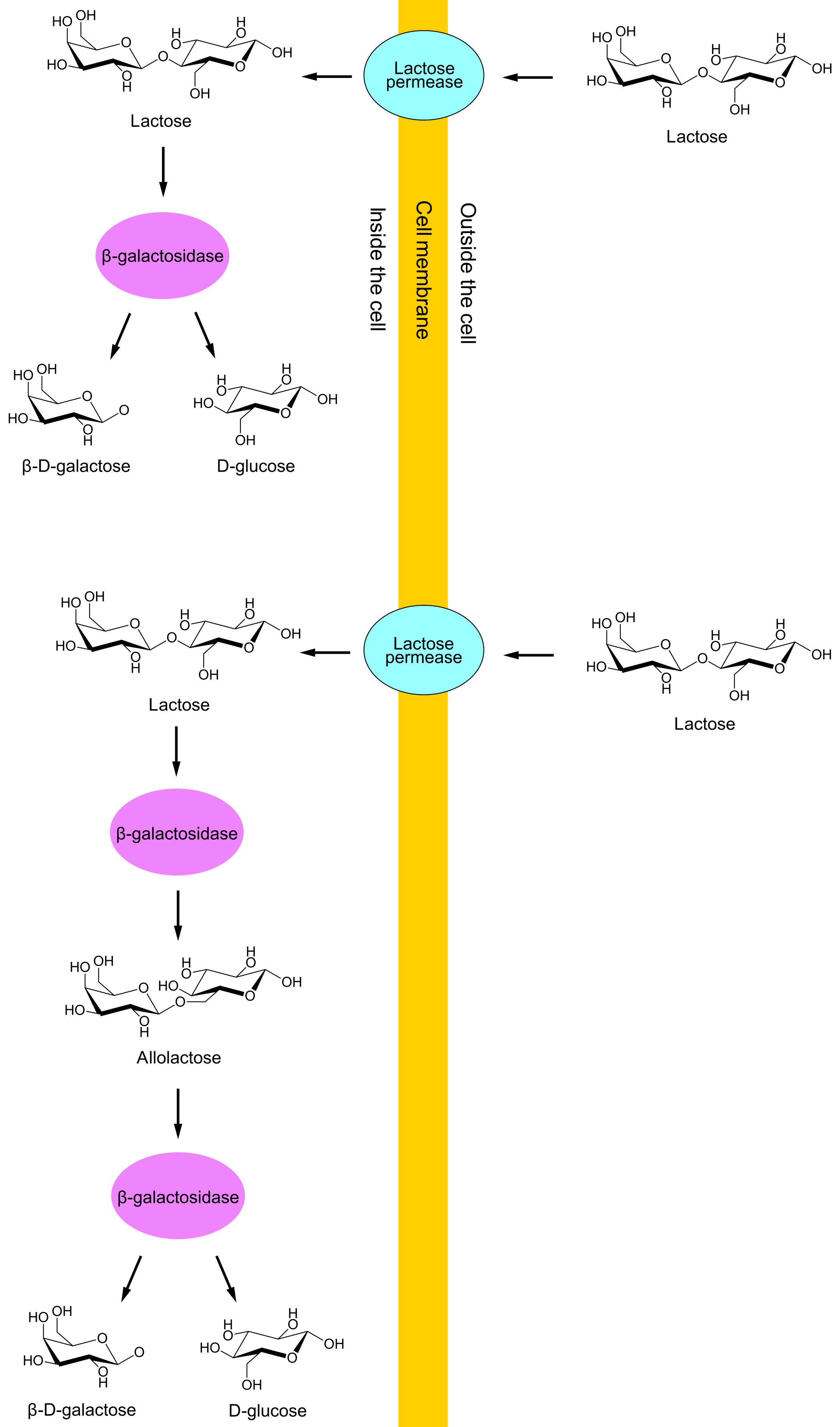
Syntese av lac-proteinene (laktose permeaser og β-galaktosidaser) er bortkastede ressurser dersom cellenes vekstmiljø mangler laktose. Videre kan E. coli vokse raskere på glukose enn på laktose, ettersom cellene bruker glukose direkte mens laktose må omdannes til glukose før bruk. Syntese av lac-proteinene er derfor også uøkonimisk hvis vekstmiljøet inneholder mye glukose. Av disse to grunnene er transkripsjon av lac-genene kontrollert gjennom opptak av laktose og glukose.
(For å være mer spesifikk angående raskere vekst på glukose vs laktose: Hogema 1998 viser doblingstidene til E. coli MG1655 dyrket i medium med ulike energikilder på 37 °C. Cellene i glukose-medium (0.2 gram glukose per 100 ml medium) hadde en doblingstid på 60 minutter, mens cellene i laktose-medium (0.2 gram laktose per 100 ml medium) hadde en doblingstid på 77 minutter. Doblingstiden er tiden en bakterie-populasjon bruker for å vokse til dobbel størrelse, så kortere doblingstid betyr raskere vekst.)
Laktose og transkripsjon av lac-genene
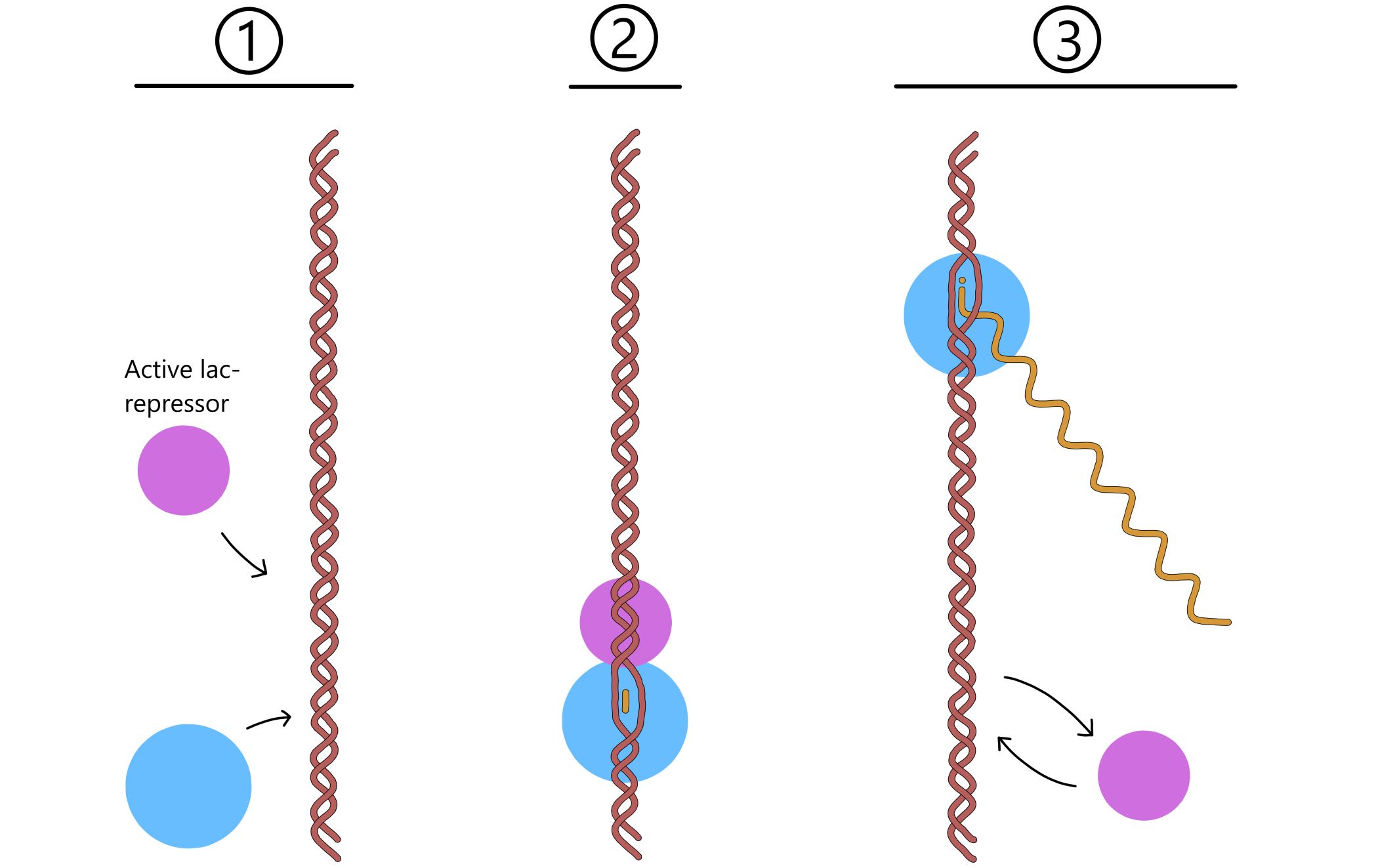
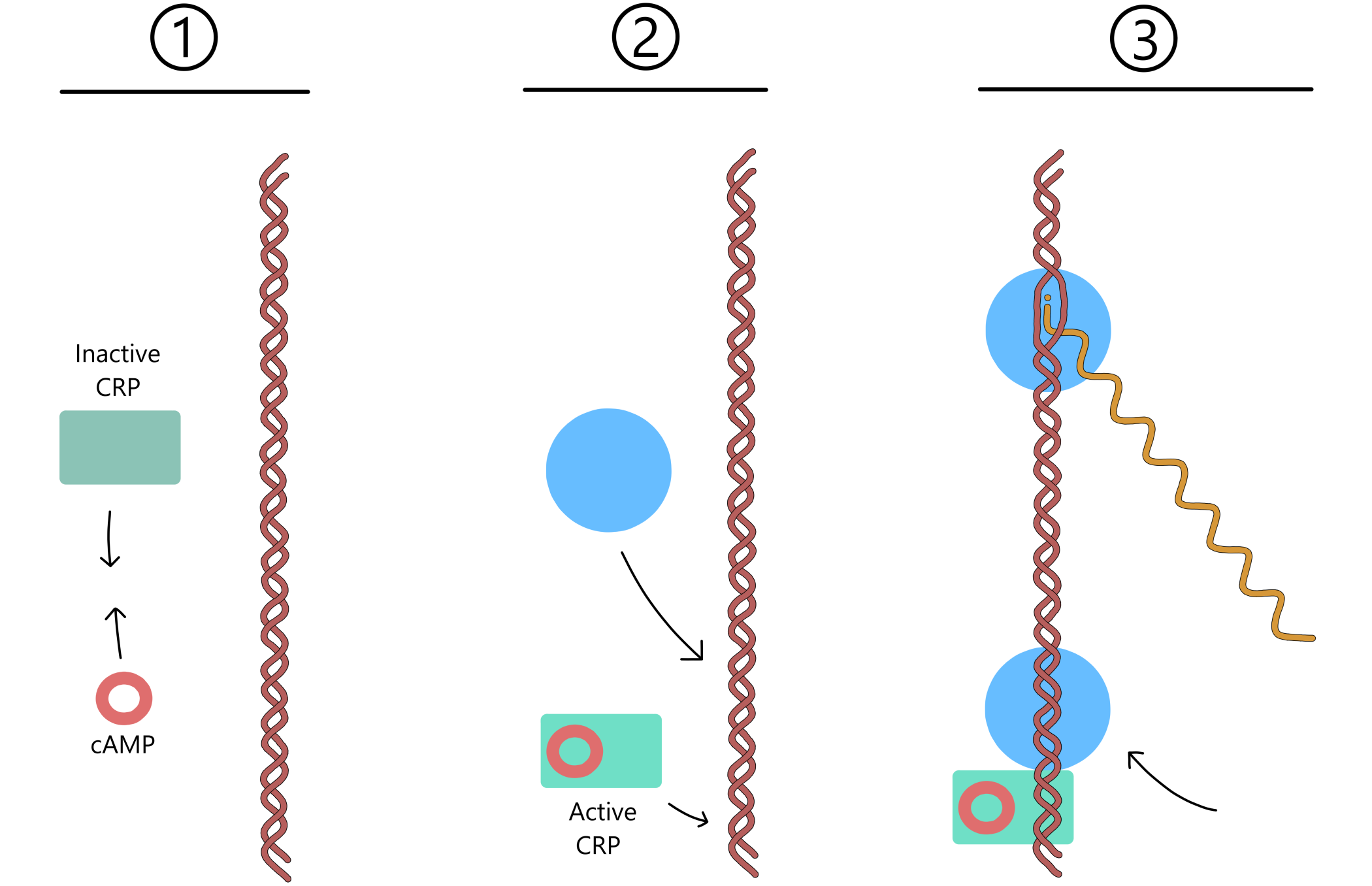
Laktose-opptak kontroller transkripsjon av lac-genene ved hjelp av proteiner kalt lac-repressorer, sammen med en basesekvens kalt lac-operatoren som ligger nær lac-promoteren. (Som med promoter-elementer, så er ikke lac-operatoren kun én sekvens, den består av to komplementære sekvenser i templat- og non-templat-DNA.) Når laktose ikke finnes i vekstmiljøet er repressorene i aktiv (DNA-bindende) form, og en av dem kan binde til operatoren. Repressoren blokkerer da RNApol fra å bevege seg langs DNA, og hindrer dermed transkripsjon fra lac-promoteren.
En aktiv repressor er ikke permanent bundet til operatoren og vil etter hvert løsne. RNApol kan da utføre transkripsjon av lac-genene i en kort tid før en repressor igjen binder operatoren og på ny blokkerer RNApol (se Figur 2). En E. coli-bakterie har derfor alltid noen laktose permeaser i cellemembranen og noen β-galaktosidaser inne i cellen. Dette betyr at dersom laktose blir tilgjengelig i vekstmiljøet kan noe laktose entre cellen via permeasene, og β-galaktosidasene kan så omdanne en del av denne laktosen til allolaktose.
En allolaktose kan binde til en lac-repressor, og repressoren skifter da til sin inaktive form som ikke kan binde til operatoren. Hvis det er mye laktose i vekstmiljøet vil cellen få nok allolaktose til å inaktivere alle (eller de fleste) repressorene. RNApol kan da transkriptere lac-genene uten å bli blokkert, slik at transkripsjonsraten øker. Dette lar cellen lage flere laktose permeaser og flere β-galaktosidaser, som muliggjør raskere opptak og nedbrytning av laktose.
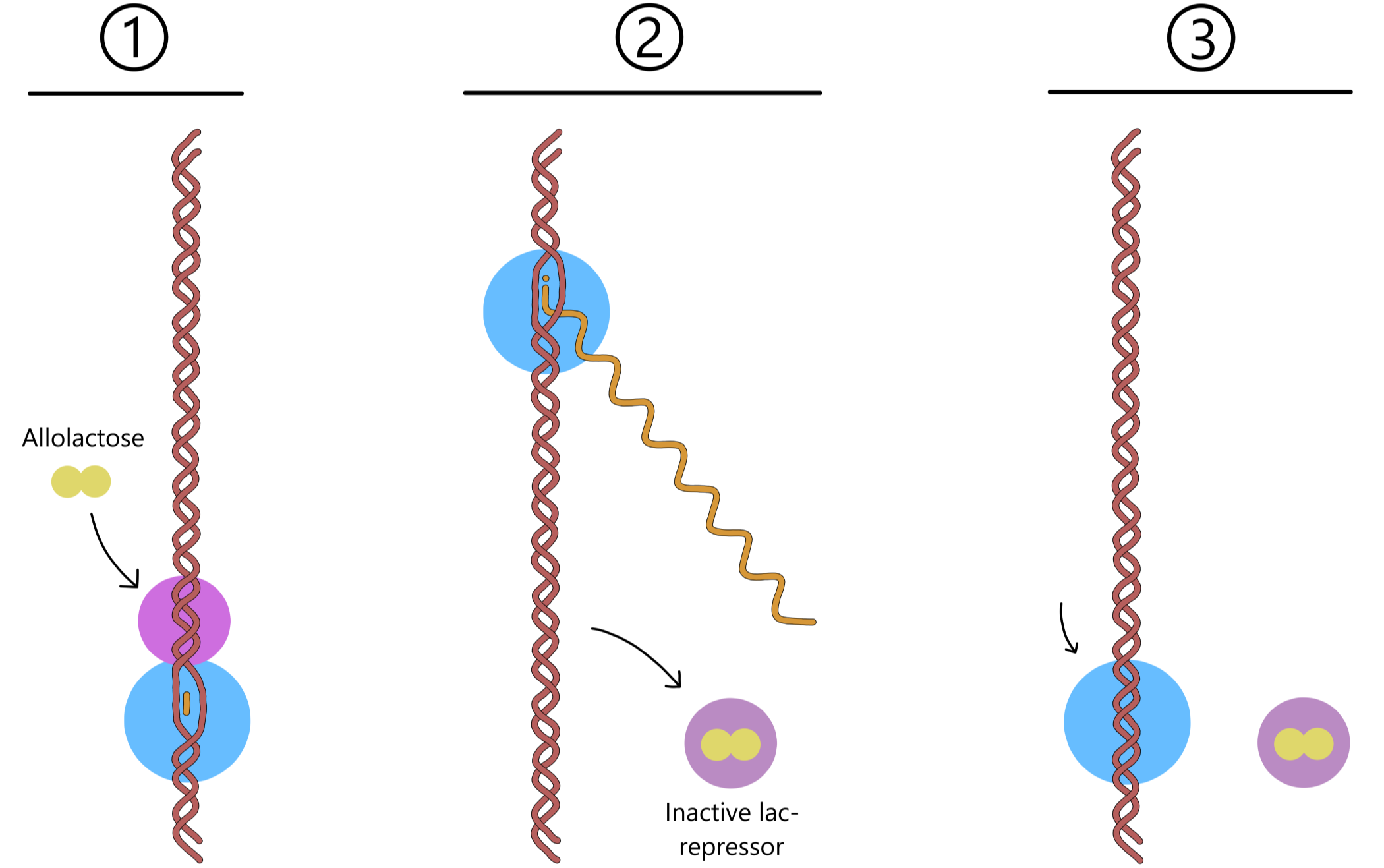
Etter en stund løsner allolaktose fra repressoren og brytes ned til glukose og galaktose via β-galaktosidase. Dersom laktose fortsetter å entre cellen dannes ny allolaktose som igjen binder repressoren, slik at den forblir inaktiv. Når laktose ikke lenger er tilgjengelig blir allolaktose nedbrutt uten å bli erstattet av ny allolaktose. Repressorene skifter da til sine aktive former, og en av dem kan binde til operatoren slik at transkripsjonsraten til lac-genene reduseres.
Glukose og transkripsjon av lac-genene
Glukose-opptak kontrollerer transkripsjon av lac-genene via en mekanisme som involverer proteiner i E. coli's PEP:glukose-phosphotransportsystem (PTS). Et av disse PTS-proteinene er EIICBGlc, som flytter glukose fra vekstmiljøet gjennom cellemembranen og inn i cellen. Samtidig som at glukosen flyttes så overføres en kovalent bundet fosfat fra EIICB til glukosen.
Før EIICB kan flytte en ny glukose inn i cellen må EIICB "lades opp" med en ny fosfat. Denne ladingen utføres av tre andre PTS-proteiner kalt EI, HPr og EIIAGlc, sammen med fosfat-kilden PEP (phosphoenolpyruvat). Den kovalente fosfaten overføres fra PEP til EI, fra EI til HPr, fra HPr til EIIA, og fra EIIA til EIICB. At en fosfat overføres til et protein betyr at fosfaten binder kovalent til et bestemt atom i aminosyrekjeden. (For eksempel, ifølge Dorschug 1984 blir fosfat kovalent bundet til EIIA på aminosyren histidin-91, altså en histidin som er aminosyre nummer 91 når man teller fra proteinets N-terminus. Hans resultater antydet videre at fosfat blir bundet til nitrogen-3 i den variable gruppen hos denne histidin.)
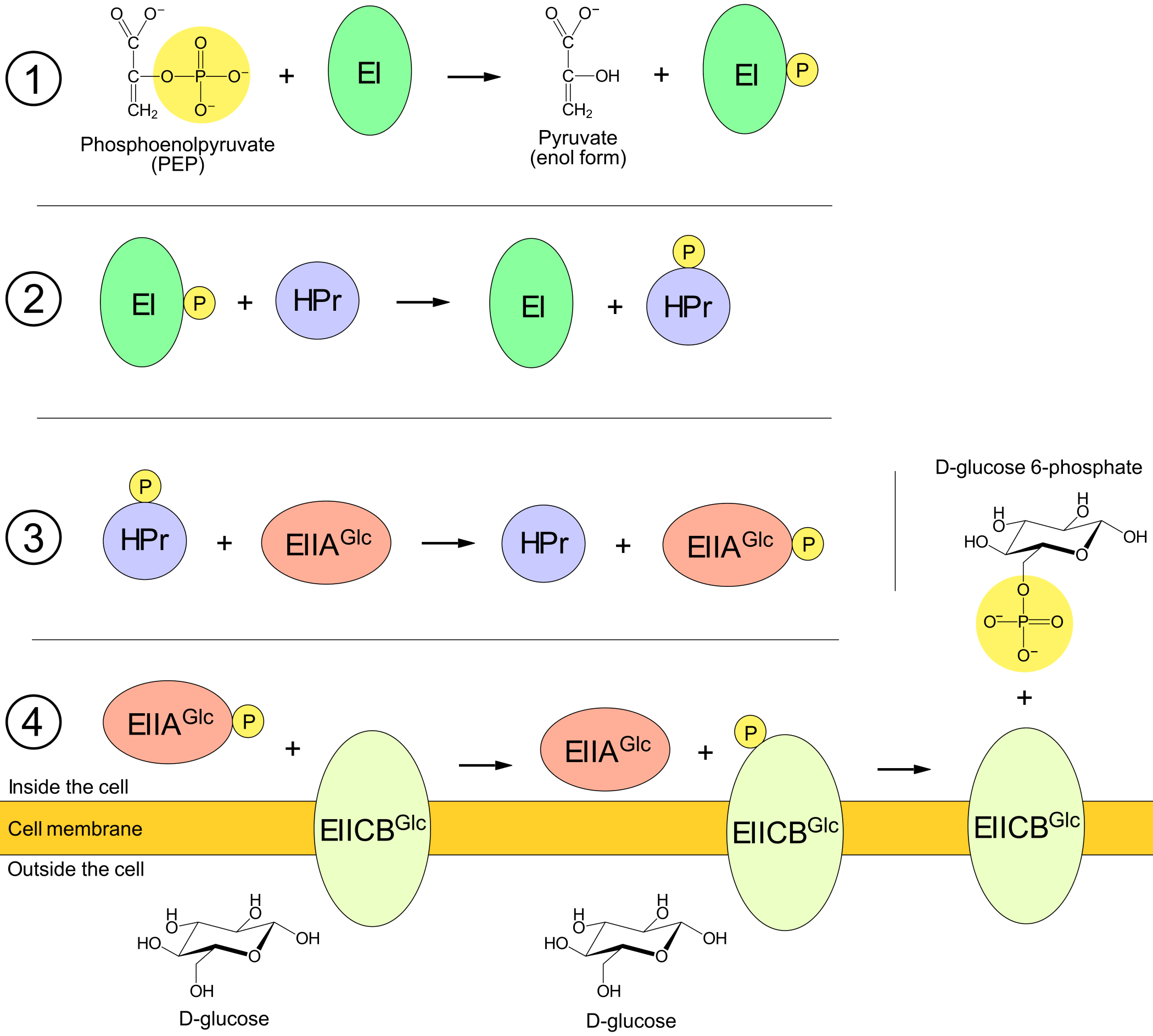
Dersom E. colis vekstmiljø inneholder mye glukose kan fosfat effektivt overføres fra PTS-proteinene til glukose. Konsekvensen blir at majoriteten av PTS-proteinene vil være defosforylerte (den tilstanden hvor de ikke er bundet kovalent til fosfat). Hogema 1998 fant at opptil 97% av alle EIIA kan være defosforylerte under vekst på glukose.
EIIA har andre funksjoner enn overføring av fosfat til EIICB. Når en EIIA er defosforylert kan den binde og inaktivere en laktose permease, slik at permeasen ikke kan transportere laktose gjennom cellemembranen. Når nesten alle EIIA er defosforylerte kan de inaktivere en stor del av laktose permeasene. Mekanismen hvor laktose entrer cellen, omstruktureres til allolaktose og inaktiverer lac-repressorene, vil altså ikke fungere når vekstmiljøet inneholder mye glukose.
Hvis glukose skulle forsvinne fra vekstmiljøet, for eksempel ved at E. coli-cellene bruker opp all glukosen, så kan ikke PTS-proteinene overføre fosfat til glukose. Fosfat begynner da å akkumulere på PTS-proteinene, slik at andelen defosforylerte proteiner faller mens andelen fosforylerte proteiner øker.
Kun defosforylert EIIA kan inaktivere laktose permease, så når andelen defosforylerte EIIA faller vil flere laktose permeaser bli aktive. Dersom laktose er tilgjengelig i vekstmiljøet kan den nå entre cellen og inaktivere lac-repressorene, slik at transkripsjonsraten til lac-genene øker.
cAMP og transkripsjon av lac-genene
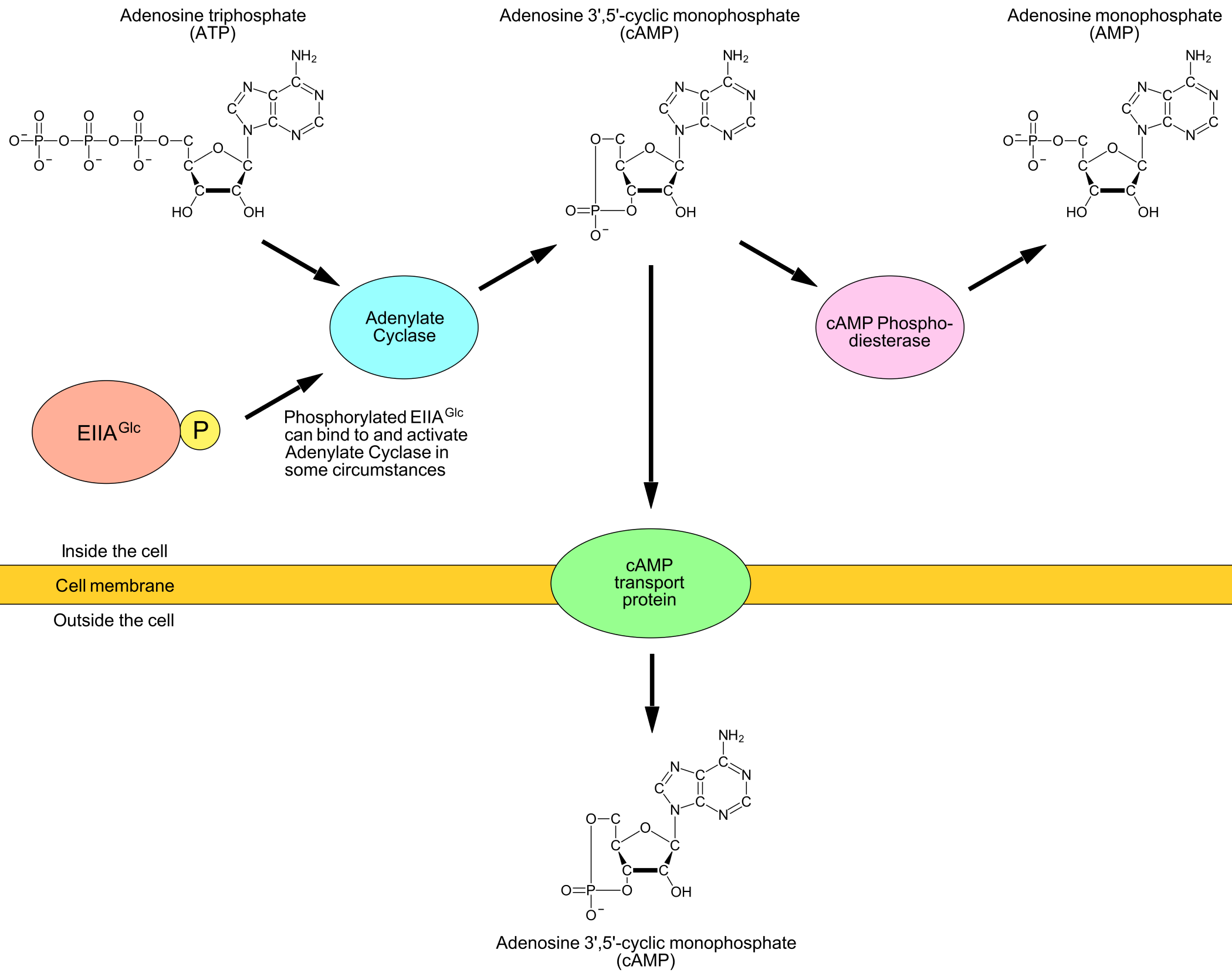
CRP (cAMP receptor protein) kan øke transkripsjon av lac-genene ved å binde til CRP-sekvensen i lac-promoteren. Når CRP og cAMP (cyclic adenosine 3’-5’-monophosphate) binder sammen vil CRP skifte til aktiv (DNA-bindende) form. Når cAMP etter hvert løsner skifter CRP tilbake til inaktiv form (som ikke lenger binder DNA).
Dette betyr at når cellen har mye cAMP så binder cAMP og CRP effektivt sammen, slik at majoriteten av CRP skifter til aktiv form og transkripsjonsraten fra lac-promoteren blir relativt høy. Når cellen derimot har lite cAMP så binder cAMP og CRP mindre effektivt sammen, slik at majoriteten av CRP er i inaktiv form og transkripsjonsraten er relativt lav.
(Det bør nevnes at aktiv CRP ikke bare påvirker transkripsjon fra lac-promoteren, men også fra et stort antall andre promotere som ikke vil omtales i denne artikkelen.)
Mange biologi-bøker (inkludert Lehninger Principles of Biochemistry (2021), Brock Biology of Microorganisms (2015), Genetics: A Conceptual Approach (2014), Molecular Biology of The Cell (2015), Biology: A Global Approach (2015), Molecular Biology (2013)) skriver at når glukose er fraværende i E. colis vekstmiljø (slik som når cellene dyrkes i laktose) så vil cellene ha en høy konsentrasjon av cAMP. Hvis glukose derimot er tilstede vil cellene ha en lav konsentrasjon av cAMP.
Men dette har blitt vist å ikke stemme helt. Inada 1996 målte at cAMP økte betydelig når celler av E. coli byttet næringskilde fra glukose til laktose, men at denne økningen bare var kortvarig, og at cAMP falt tilbake til det tidligere nivået når cellene hadde tilpasset seg endringen til laktose.
Mer nøyaktig så ble E. coli W3110 dyrket i medium med 0.04 gram glukose og 0.2 gram laktose per 100 ml. Cellene vokste derfor først på glukose, og etter at glukosen ble brukt opp så fortsatte de å vokse på laktose. Under vekst på glukose var cAMP-konsentrasjonen i cellene rundt 2.3 mikromolar. cAMP steg til rundt 14.5 mikromolar i overgangen fra vekst på glukose til laktose, og falt til rundt 1.3 mikromolar når cellene vokste effektivt på laktose.
Inada antok at den kortvarige cAMP-økningen muliggjør en raskere overgang til effektiv vekst på laktose, ved at transkripsjonen av lac-genene akselereres inntil cellen har nok lac-proteiner. Når cellen har nok proteiner kan høy transkripsjon opprettholdes ved at cellen produserer mye allolaktose, som inaktiverer lac-repressorene.
Inada's resultat støttes av Hogema 1997, som studerte hvordan ulike energikilder påvirket cAMP-konsentrasjonen i E. coli MG1655. Næringsmiddelet laktat ble brukt som referanse, og celler som kun vokste på laktat (0.4 gram per 100 ml medium) hadde en høy cAMP-konsentrasjon (3.3 mikromolar). I celler som vokste på laktat tilsatt glukose (0.2 gram glukose per 100 ml) var cAMP-konsentrasjonen redusert til 0.72 mikromolar. Hos celler som vokste på laktat tilsatt laktose (0.2 gram per 100 ml) var cAMP redusert i tilsvarende grad (til 0.70 mikromolar). cAMP-konsentrasjonen var altså ikke noe høyere ved vekst på laktose sammenlignet med glukose.
Hvordan cAMP-konsentrasjonen i cellene kontrolleres er ennå ikke fullstendig forstått (ihvertfall har jeg ikke funnet ut av alle detaljene). Det som vites er presentert i Figur 6.
Kontroll av laktose-transport
Som nevnt før, ved vekst på glukose er 97% av EIIA i defosforylert tilstand. Når glukosen blir brukt opp kan ikke fosfat overføres fra EIIA til EIICB til glukose, så fosfat akkumulerer på EIIA. Dette betyr at andelen defosforylert EIIA faller mens andelen fosforylert EIIA øker. En kunne kanskje tro at etter nok tid vil 100% av EIIA bli fosforylert, men dette skjer ikke.
Hogema 1998 fant at under vekst på laktose vil kun 42% av EIIA være fosforylerte. Grunnen er at fosfat ikke utelukket overføres fra PEP til PTS-proteinene til glukose, som beskrevet tidligere. Fosfat kan også gå i motsatt retning, fra PTS-proteinene til pyruvat (som omdannes til PEP). Høyere PEP-konsentrasjoner gir økt overføring av fosfat fra PEP til PTS-proteinene, og høyere pyruvat-konsentrasjoner gir økt overføring av fosfat fra PTS-proteinene til pyruvat. Akkumulering av fosfat på EIIA påvirkes derfor av de relative konsentrasjonene av PEP og pyruvat.
Hvis 42% av EIIA er fosforylerte under vekst på laktose så er 58% defosforylerte, og i teorien kan disse defosforylerte EIIA binde og inaktivere noen laktose permeaser slik at laktose-opptak reduseres (selv når laktose er cellenes eneste energikilde). Dette høres rart ut, men ifølge Hogema 1999 ser det ut til å stemme. For å teste dette sammenlignet han vanlige E. coli MG1655 med E. coli-mutanter hvor laktose permeasene er resistante mot deaktivering.
Et av hans forsøk handlet om hastigheten på laktose-opptak. E. coli-cellenes medium ble tilsatt laktose, og etter seks minutter hadde mutantene tatt opp omtrent dobbelt så mye laktose (≈185 nanomol per milligram tørr cellevekt) sammenlignet med MG1655 (≈95). (Både mutantene og MG1655 ble dyrket i medium tilsatt cAMP slik at cAMP-nivået i cellene ble kunstig høyt grunnet cAMP-opptak, dette var nødvendig for å få en tilnærmet lik mengde laktose permeaser i alle cellene.)
Hogema ønsket dernest å se om inaktivering-resistente laktose permeaser påvirket cellenes veksthastighet på laktose (ikke supplementert med cAMP). Han fant at både mutantene og MG1655 hadde lignende doblingstid (1.22 timer for mutantene mot 1.33 for MG1655), men antallet laktose permeaser i mutantene var mye lavere enn i MG1655. Dette ble bestemt ved å måle enzym-aktiviteten til β-galaktosidasene, med antakelse om at β-galaktosidase-aktiviteten er proporsjonal til antallet laktose permeaser. Hos mutantene ble β-galaktosidase-aktiviteten målt til 1370 Miller-enheter, mot 2940 hos MG1655, noe som indikerer omtrent 50% færre permeaser i mutantene vs i MG1655. Dette antyder at mutantene kompenserte for manglende permease-inaktivering ved å redusere mengden permeaser.
For å teste om mutantenes veksthastighet kunne påvirkes av en økning i antall laktose permeaser ble mutantene dyrket i medium tilsatt cAMP. Dette resulterte i at β-galaktosidase-aktiviteten økte fra 1370 til 3395 Miller-enheter (som indikerer mer enn en dombling i antallet permeaser) mens doblingstiden økte fra 1.22 til 1.75 timer. Dette antyder derfor at veksthastigheten kan reduseres dersom cellene har for stort opptak av laktose, som isåfall forklarer hvorfor laktose permeaser kan inaktiveres under vekst på laktose. (MG1655 ble også dyrket med cAMP, men dette påvirket ikke deres doblingstid.)
Merk at inaktiveringen av permeaser under vekst på laktose er langt fra like stor som ved vekst på glukose. Dette er dels fordi det finnes mange flere permeaser, og dels fordi det er færre defosforylerte EIIA (ihvertfall hvis en antar at total konsentrasjon av EIIA er uavhengig av om cellen vokser på glukose eller laktose).
Oppsummering
E. coli's lac-promoter består av en −10-sekvens, en −35-sekvens, og en CRP-sekvens. RNApol starter transkripsjon fra promoteren ved å binde til −10/35-sekvensene via sigma70. Aktiv CRP (altså CRP bundet til cAMP) kan binde til CRP-sekvensen for å øke transkripsjonsraten fra promoteren.
Transkripsjon fra lac-promoteren kan reduseres ved at en lac-repressor binder til operator-sekvensen nær lac-promoteren. Dersom cellen tar opp laktose vil noe av laktosen omdannes til allolaktose, som kan binde og inaktivere cellens lac-repressorer. Dette øker transkripsjonsraten fra lac-promoteren.
Dersom glukose er til stede i E. coli's vekstmiljø vil glukose-opptak føre til defosforylering av PTS-proteinet EIIAGlc, som så kan binde og inaktivere laktose permease og stoppe cellens opptak av laktose. Lac-repressorene forblir da aktive og reduserer transkripsjon fra lac-promoteren selv om laktose skulle være tilstede i vekstmiljøet.
I noen situasjoner vil konsentrasjonen av cAMP øke, som betyr flere aktive CRP og økt transkripsjon av lac-genene. For eksempel, dersom E. colis vekstmiljø inneholder både glukose og laktose vil cellene først bruke glukose som energikilde. Når glukosen begynner å bli brukt opp vil cellene i økende grad produsere lac-proteiner for å bruke laktose som energikilde. En midlertidig økning i cAMP fører til en akselerert syntese av lac-proteiner og dermed en raskere tilpasning til laktose.
Når cellen har nok lac-proteiner til å utnytte laktose effektivt vil cAMP-konsentrasjonen reduseres. Høy transkripsjonsrate fra lac-promoteren opprettholdes da av at cellene produserer mye allolaktose som holder lac-repressorene inaktive.
Kilder
Bahl, Wu, Stawinsky, Narang
(1977): Minimal length of the lactose operator sequence for the specific recognition by the lactose repressor. Fri artikkel
Berg, von Hippel
(1988): Selection of DNA Binding Sites by Regulatory Proteins [Part II] The Binding Specificity of Cyclic AMP Receptor Protein to Recognition Sites. Betalt artikkel
Blattner, Ill, Block, Perna, Burland, Riley, Collado-Vides, Glasner, Rode, Mayhew, Gregor, Davis, Kirkpatrick, Goeden, Rose, Mau, Shao
(1997): The Complete Genome Sequence of Escherichia coli K-12. Betalt artikkel
Dorschug, Frank, Kalbitzer, Hengstenberg, Deutscher
(1984): Phosphoenolpyruvate-dependent phosphorylation site in enzyme IIIGlc of the Escherichia coli phosphotransferase system. Fri artikkel
Kommentar: I eldre vitenskapelige tekster som denne er EIIAGlc kalt EIIIGlc.
Hogema, Arents, Bader, Eijkemans, Yoshida, Takahashi, Aiba, Postma
(1998): Inducer exclusion in Escherichia coli by non-PTS substrates: the role of the PEP to pyruvate ratio in determining the phosphorylation state of enzyme IIAGlc.
Fri artikkel
Hogema, Arents, Bader, Postma
(1999): Autoregulation of lactose uptake through the LacY permease by enzyme IIAGlc of the PTS in Escherichia coli K-12. Fri artikkel
Hogema, Arents, Inada, Aiba, van Dam, Postma
(1997): Catabolite repression by glucose 6-phosphate, gluconate and lactose in Escherichia coli. Fri artikkel
Inada, Kimata, Aiba
(1996): Mechanism responsible for glucose–lactose diauxie in Escherichia coli: challenge to the cAMP model. Fri artikkel
Lisser, Margalit
(1993): Compilation of E.coli mRNA promoter sequences. Fri artikkel